Phénotypage, génotypage, intelligence artificielle, jumeaux numériques... une nouvelle ère pour la médecine personnalisée

Véritable enjeu de santé publique, les pathologies rétiniennes sont à l’origine de divers handicaps visuels, et de répercussions variables sur la vie sociale et professionnelle des patients concernés. Face à la diversité des atteintes se joue une recherche de pointe et multi-focalisée afin de proposer à chacun la prise en charge la plus adaptée, essence même du concept de médecine personnalisée. C’est toute l’ambition de l’équipe S6 du Département de génétique fondée en 2007 au sein de l'Institut de la Vision à Paris, co-dirigée par la Pr Isabelle Audo et la Dr Christina Zeitz, et qui s’intéresse tout particulièrement aux maladies de la rétine d’origine génétique. Phénotypage et génotypage sont les axes de recherche essentiels de cette équipe, couplés aux avancées de l’intelligence artificielle (IA). De tout évidence la médecine ne pourra qu’être de plus en plus personnalisée ! Décryptage.


En photo : à gauche, Pr Isabelle Audo, médecin chercheuse spécialisée dans les maladies rétiniennes génétiques, professeure en ophtalmologie à Sorbonne Université et coordinatrice du Centre des Maladies Rares à l’hôpital des Quinze-Vingts. À droite, Dr Christina Zeitz, chercheuse et directrice de recherche Inserm, experte dans l’identification des gènes impliqués dans les maladies rétiniennes. ©Institut de la Vision - SU/LArdhuin
DMLA, rétinopathie diabétique, glaucomes, maladies génétiques, pathologies inflammatoires, cancers oculaires… autant de pathologies qui bénéficient déjà, et seront amenées à bénéficier toujours plus, des progrès diagnostiques et thérapeutiques spectaculaires en ophtalmologie de ces dernières décennies. Corrélé à ces progrès figure l’enjeu de la personnalisation de la prise en charge médicale, tenant compte des différences individuelles et faisant appel à l’adaptation des ophtalmologues eux-mêmes. Outre leur formation initiale, à travers laquelle les principales affections ophtalmologiques sont connues et reconnues, ces derniers se doivent être au fait des avancées majeures en phénotypage, génotypage, imagerie et intelligence artificielle. A l’aube d’une nouvelle ère, la médecine personnalisée appelle une plus ample connaissance et une plus grande réactivité des praticiens, afin d’améliorer la prédictibilité tant sur le champ de la prévention que de l’efficacité thérapeutique. A la clé, la réduction des effets indésirables - parfois pernicieux - liés à des thérapies non parfaitement adaptées à l’individu et le maintien du pronostic visuel le plus longtemps possible afin d’éviter les conséquences délétères de la malvoyance.
“ Dans le monde, un adulte
sur 2 000* serait touché par
une pathologie rétinienne d’origine
génétique ”
*Berger et al., 2010
Les pathologies de la rétine d'origine génétique, état des lieux
Les maladies rétiniennes d'origine génétique provoquent de nombreux cas de cécité ou de troubles visuels majeurs, générant un handicap de grade variable dans le quotidien des patients. Dans le monde, on considère qu’environ un adulte sur 2 000* est touché par des pathologies telles que la rétinite pigmentaire, la maladie de Stargardt ou des pathologies plus rares, comme la choroïdérémie ou l'atrophie gyrée.
Dans certains cas, la maladie peut être stationnaire, « établie », alors que pour de nombreuses pathologies, le trouble est progressif, conduisant à un handicap visuel sévère. De la diminution ou perte d’acuité visuelle à la disparition d’une partie du champ de vision (tel dans la DMLA), en passant par les éblouissements, l’apparitions de taches lumineuses ou d’éclairs (phosphènes), de photophobie (intolérance à la luminosité), de retard d’adaptation à l’obscurité pouvant aboutir à la cécité nocturne, ou encore aux déformations de la perception visuelle (lignes déformées, couleurs troublées)... la “palette des dégâts” est étendue.
Pour l’heure, les options thérapeutiques pour préserver - voire rétablir - la fonction visuelle des patients restent limitées, « standard », faute d’une connaissance plus approfondie des causes inhérentes à chaque cas. Raison pour laquelle l’analyse fine des mécanismes pathologiques sous-jacents et la recherche en vue de la compréhension des maladies rétiniennes héréditaires sont des leviers majeurs de progrès thérapeutiques.

En photo : plateforme de séquençage pour analyser les séquences codantes des gènes impliqués dans les maladies rétiniennes héréditaires et identifier les défauts génétiques.
Phénotypage et génotypage : des "clés" de connaissance incoutournables
« Partie visible de l’iceberg », le phénotype correspond à l’observation clinique de la pathologie. Aussi le phénotypage consiste-t-il à analyser scrupuleusement les dystrophies rétiniennes ainsi que les manifestations cliniques présentées par les patients… Et demande à être mis en corrélation avec le génotypage.
« Un de nos objectifs au sein de l’équipe est de caractériser génétiquement une large cohorte de patients, dont la majorité a été cliniquement évaluée et suivie à l’hôpital des Quinze-Vingts » expliquent la Dr Christina Zeitz et la Pr Isabelle Audo.
« La corrélation phénotype/génotype consiste à associer des données génétiques à la forme clinique de la maladie, à sa sévérité, mais aussi aux prémices de la manifestation des symptômes et de leur progression. »
Au-delà de l’observation clinique, fondamentale mais préliminaire, c’est surtout l’étude génétique des patients qui va permettre d’identifier et comprendre les origines de la pathologie. Ce génotypage va en effet consister à rechercher des variations génétiques sur une partie déterminée du génome (liée à la vision), et à déterminer si ces variations sont liées à l’ensemble de l’espèce humaine, à une autre espèce dont l’ADN serait étudié… ou propres à un individu et dès lors « incriminables » dans la pathologie d’intérêt. [Voir encadré "L’analyse de l’ADN, en pratique”].
"À l’heure actuelle,
près de 300 gènes ont
été associés aux maladies rétiniennes
d'origine génétique"
L'analyse de l'ADN en pratique
Elle se fait à partir d’un prélèvement sanguin dont est extrait le matériel génétique, à partir duquel vont être recherchés les variants après séquençage. « Nous avons tous en nous des variants génétiques, mais seuls certains peuvent donner des maladies » explique la Dr Zeitz, rappelant que dans 70% des cas, les gènes identifiés sont déjà connus.
Pour l’heure, près de 300 gènes ont été associés aux maladies rétiniennes d'origine génétique. Lorsqu’aucun défaut génétique n’est identifié chez le patient, la stratégie consiste alors à explorer et identifier d’autres gènes et leurs fonctions respectives afin d’identifier de nouvelles cibles thérapeutiques. « Nous nous intéressons à quelques gènes en particulier pour développer certaines approches thérapeutiques » précise la Pr Audo.

En photo : plateforme de séquençage pour analyser les séquences codantes des gènes impliqués dans les maladies rétiniennes héréditaires et identifier les défauts génétiques.
A noter que les pathologies rétiniennes génétiques sont très complexes : des mutations sur plusieurs gènes peuvent conduire à un phénotype commun, et inversement diverses mutations sur un seul gène peuvent entraîner des manifestations cliniques différentes ! La laborieuse corrélation phénotype/génotype qui consiste à associer des données génétiques à la forme clinique de la maladie, a certes pour finalité de corréler les causes des pathologies aux symptômes qu’elles induisent chez les patients mais aussi de comprendre la potentielle sévérité d’une pathologie, de modéliser sa progression, et d’anticiper le moment où, quand des traitements seront disponibles, il sera alors possible de choisir de façon plus ciblée, parmi les différentes options thérapeutiques, celles qui seront les plus pertinentes pour chaque sujet.
Connaître le gène muté est en effet une nécessité afin d’adapter LA « bonne » thérapie génique au « bon » patient, à l’instar de l’identification de mutations sur le gène RPE65 qui permet l’administration « sans faute », fonctionnelle et efficace de la thérapie par Luxturna, seul traitement disponible à date.
En s’intéressant aux défauts génétiques sous-jacents à la pathologie rétinienne de tel ou tel patient, les chercheurs ont en ligne de mire le développement de thérapie génique innovante et personnalisée adaptée au besoin de chaque patient. L’étude du profil génétique des patients, permet par ailleurs, à défaut d’une thérapie génique éprouvée mais grâce à la caractérisation moléculaire, de prodiguer des conseils personnalisés quant à la pathologie identifiée et au risque héréditaire.
« La thérapie génique sera personnalisée sur le gène muté à l’origine de la maladie rétinienne et adaptée à des critères phénotypiques précis »
Un patient souffrant par exemple de la maladie de Stargardt, qui est associée à une accumulation anormale de débris de vitamine A, se verra conseiller un régime alimentaire particulier, limitant les aliments riches en vitamine A ou en bêtacarotène. Un patient atteint d’atrophie gyrée, lui, pourra bénéficier d’une prise en charge diététique très spécifique pour parer à la modification du métabolisme de certains acides aminés. Cette aide pourra être proposée suite à l’analyse de son ADN par le centre.
« En obtenant une caractérisation génétique plus précise, nous comprenons pourquoi des gènes défaillants sont associés à des pathologies rétiniennes chez les patients » expliquent les chercheuses : « Nous pouvons alors procéder à des essais cliniques qui répondent au plus près des besoins thérapeutiques de nos patients. C’est le cas des thérapies géniques qui cherchent à soigner, à réparer les gènes altérés causant les maladies. »
Les promesses de l'IA et des modèles ... cellulaires ou digitaux
Domaine de recherche en plein essor, l’intelligence artificielle (IA) est au cœur de la médecine du futur, technologique et personnalisée. Qu’il s’agisse d’opérations chirurgicales robotisées et assistées, de prothèses intelligentes, d’applications santé mobiles personnalisées ou de traitement des données de santé telles celles issues de l’imagerie médicale ou des analyses biologiques (Big Data)... l’IA lève le voile sur une médecine complètement revisitée à l'aune des algorithmes. L’ophtalmologie figure « naturellement » au tableau des disciplines qui bénéficient des avancées majeures de l’IA puisque les données sont de plus en plus riches, complètes mais complexes. En effet, les moyens d’imagerie reposent sur des technologies toujours plus sophistiquées, qui permettent une analyse non invasive et quasi microscopique des atteintes au niveau des tissus oculaires, générant des données massives. La corrélation des données cliniques et biologiques grâce à l’IA permet non seulement d’optimiser la précision diagnostique mais également d’enrichir les expériences grâce potentiellement à des « jumeaux numériques », qui viennent compléter les modèles cellulaires dont dispose l’Institut.
Disponibles déjà depuis une dizaine d’années [Prix Nobel de médecine 2012, Pr Yamanaka], ces derniers, dérivés des patients, sont cruciaux pour comprendre les mécanismes cellulaires associés aux défauts génétiques. Il s’agit de cellules souches pluripotentes induites, « induced pluripotent stem cells » ou cellules iPS obtenues grâce à une prouesse scientifique et technique qui consiste à prélever une cellule humaine adulte - de peau par exemple - et de la reprogrammer génétiquement afin de la rendre pluripotente, à savoir capable de se multiplier indéfiniment tant que de se différencier en n’importe quel type de cellule du corps humain, à l’instar des cellules souches embryonnaires.
La mise à disposition de ces modèles cellulaires au sein de l’Institut de la Vision, incontournables pour la modélisation des nouveaux défauts génétiques, est due au Dr Goureau.
Les modèles digitaux, sorte de doubles virtuels modélisés, s'imposent quant à eux depuis quelques années dans tous les domaines, de l’aéronautique et des transports à l’industrie mécanique, en passant par la santé… et l'ophtalmologie n’y échappe pas.
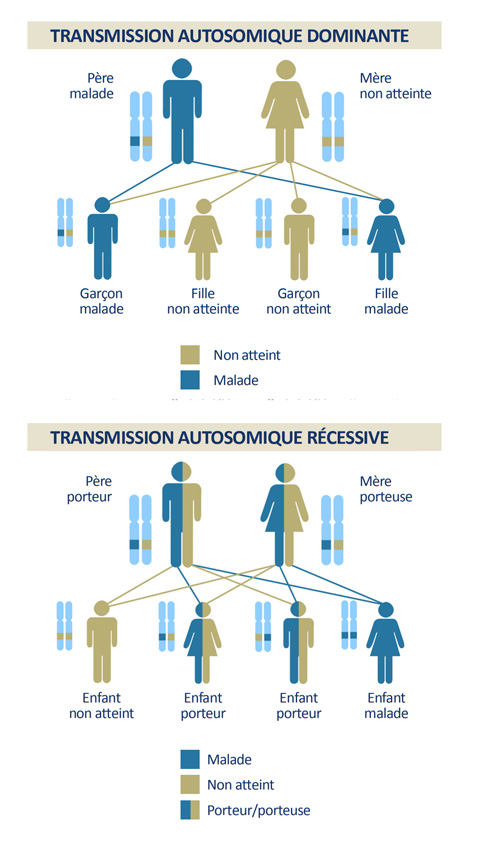
En photo : schémas descriptifs de transmission autosomique dominante ou récessive
Une synergie de technologies sophistiquées… avec quelles adaptations ?
La médecine 4.0 est bien en marche, mariant clinique, bio-informatique et numérique, et quelques règles éthiques s’imposent ! L’adoption par les professionnels de santé, dont les ophtalmologues, est un « vrai sujet » car l’IA a souvent une connotation de « boîte noire ». Dès lors qu’interviennent le Deep Learning et les réseaux de neurones artificiels, le praticien se sent en « zone d’opacité », dans laquelle il n’est pas toujours en mesure de comprendre comment l'outil a transformé les données en résultat car l'explicabilité des résultats n'est pas évidente. Or cette étape est essentielle à l’adoption des technologies, l’IA ne pouvant (et ne devant pas !) remplacer la relation médecin-patient.
Parmi les autres difficultés rencontrées dans l’usage médical, il convient de souligner que les changements technologiques et les nouvelles pratiques sur le plan diagnostic et thérapeutique re-questionnent les organisations existantes. Notamment, l'exemple des nouveaux outils d'aide à la prise de décision thérapeutique dans les cas de cancers - y compris oculaires - reposant sur des données de génomique et de protéomique, implique de restructurer le parcours de soin [Voir encadré "le parcours patient"] et d’intégrer des équipes multidisciplinaires.
Pour chaque patient il s’impose à partir du tableau clinique de choisir les tests génétiques les plus appropriés afin de rechercher la cause génétique sous-jacente. Paradoxalement, étudier les gènes de chaque individu a donc pour finalité de soigner le plus grand nombre !
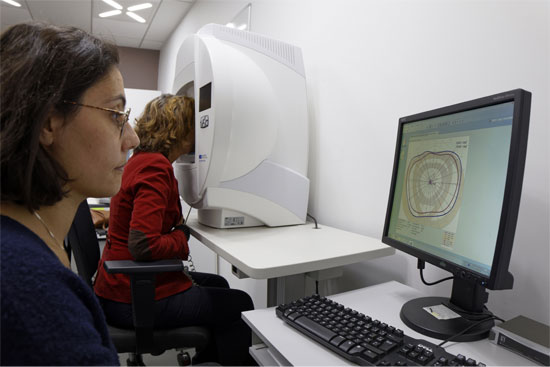
En photo : l'examen ophtalmologique par une orthoptiste, fait partie du phénotypage clinique
Le parcours du patient
Chaque patient admis au Centre de Maladies Rares de l’hôpital des Quinze-Vingts est soumis au même parcours, dit de « A à Z ». Dans un premier temps l’équipe de généticiens établit l’arbre généalogique du patient afin de déterminer le mode de transmission de la maladie : est-elle héréditaire, autosomique, récessive ou dominante, liée au chromosome X ?
Vient alors l’exploration des manifestations de la pathologie à travers plusieurs tests de la fonction visuelle : l’acuité, le champ visuel, la vision des couleurs, l’électrorétinogramme. L’observation de la structure de la rétine des patients permet dès lors de préciser le diagnostic grâce à divers tests comme l’examen du fond d’œil ou des examens spécialisés tels que la tomographie en cohérence optique (OCT) et l’autofluorescence du fond d’œil. L’ensemble de ces examens définissent les caractéristiques cliniques, phénotypiques, du patient et de sa maladie.
L’hôpital des Quinze-Vingts prend actuellement en charge plus de 10 000 patients atteints de maladies rares de la rétine, dont une majorité a été analysée génétiquement L’hôpital des Quinze-Vingts prend actuellement en charge plus de 10 000 patients atteints de maladies rares de la rétine, dont une majorité a été analysée génétiquement à l'Institut de la Vision. Il s’agit de l’une des plus grandes cohortes en France, voire en Europe, qui permet de réaliser des essais cliniques et de rendre la recherche thérapeutique d’autant plus pertinente.
Les perspectives thérapeutiques
La médecine personnalisée va permettre de proposer des traitements plus ciblés selon les caractéristiques phénotypiques et génétiques identifiées chez le patient. La thérapie génique notamment, va être typiquement personnalisée sur le gène muté à l’origine de la maladie rétinienne et adaptée à des critères phénotypiques précis.
Développée en 2012, la technique du CRISPR-Cas9 qui constitue une sorte de « paire de ciseaux » génétique spécifique capable de couper par exemple un ADN muté pour supprimer l’expression délétère de la protéine correspondante, est porteuse d’espoir pour le traitement des maladies génétiques. Elle a d’ailleurs été couronnée du prix Nobel en 2020 et des chercheurs californiens ont par exemple réussi à améliorer la vision de rats atteints d’une forme de cécité d’origine génétique. « Tel patient avec tel variant génétique sur un gène donné pourra bénéficier d’une correction génétique par exemple par CRISPR-Cas9 spécifique du variant identifié » détaille la Pr Audo, rappelant qu’une autre approche personnalisée utilisant les oligonucléotides antisens pourraient supprimer l’expression de tout ou partie d’un gène muté de façon sélective pour chaque patient. « Nous pourrions envisager que d’ici 10 à 20 ans, chaque patient puisse, selon son type de mutation, bénéficier d’un traitement « à la carte » spécifique de la mutation dont il est porteur » explique-t-elle.
De plus, l’analyse du génome entier, par l’exhaustivité des données qu’elle génère, peut non seulement identifier les causes génétiques de la pathologie rétinienne, mais aussi identifier d’autres variants pouvant avoir un impact sur la maladie, ou par exemple sur la réponse à un traitement donné. Si par exemple, pour un patient atteint de la maladie de Stargardt - caractérisée par une accumulation de débris de vitamine A - une thérapie vise à bloquer une enzyme impliquée dans la régénérescence de cette vitamine et empêcher l’accumulation de débris, l’identification d’un variant additionnel sur l’enzyme ciblée pourrait compromettre l’efficacité du traitement choisi. Ainsi, une cartographie précise du génome permettrait également de valider la cible thérapeutique.
Médecine personnalisée : paradoxalement, étudier les gènes de
chaque individu a pour finalité de soigner le plus grand nombre !
Les recherches génétiques, appliquant le séquençage haut débit ainsi que les approches de correction génique, sont cependant très onéreuses d’où la nécessité de répondre à des appels d’offres et de bénéficier de soutiens financiers divers (associations, fonds...). « La recherche de soutiens financiers constitue une grande partie de la vie d’un chercheur pour financer ces recherches coûteuses » rappelle la Pr Audo. L'Institut de la Vision est une structure qui reçoit pour son fonctionnement des dotations annuelles par ses 3 tutelles, dont l'Inserm fait partie, et qui dans le cadre du Programme d'investissements d'avenir a été labellisée Institut Hospitalo-Universitaire (IHU FOReSIGHT). D’autres sources de financements pour ce projet d’envergure proviennent de fondations et d’associations françaises mais aussi de fondations américaines.
« Nous espérons que dans l’avenir, il sera possible de proposer des thérapies soit génériques et applicables à un grand nombre de patients, soit à la carte pour une médecine plus personnalisée » appellent de leurs vœux la Pr Audo et la Dr Zeitz.
Le Guide de la Vue remercie la Pr Audo, la Dr Zeitz et l'Institut de la Vision, pour leur aimable collaboration.
Soutenez la recherche, soutenez l'Institut de la Vision >
À lire aussi

WebTV Institut de la Vision : "la médecine personnalisée"
Alors que nombre d’affections oculaires sont désormais connues et reconnues, que les progrès diagnostiques et thérapeutiques en ophtalmologie sont considérables, la très grande variabilité inter-ind
Douleur oculaire, une prise en charge unique au CHNO des Quinze-Vingts
La sécheresse oculaire est l’un des premiers motifs de consultation dans les cabinets d’ophtalmologie&nbs

Qu'est-ce que la myopie ?










